Notion de base de la corrosion et de la protection cathodique
Tout métal enterré ou immergé cherche à retourner à son état minéral par oxydo-réduction (ou d’autres transformations chimiques)
On parle principalement de corrosion électrochimique :
Pour qu’il y ait une corrosion électrochimique, il faut :
- Un métal
- Un électrolyte (milieu environnant le métal: sol, eau…)
- Un contact entre le métal et l’électrolyte
- Des conditions favorables
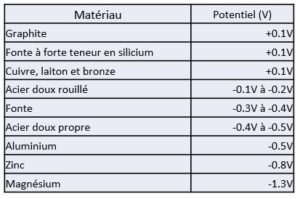
Le sens de déplacement des ions et du courant
Les ions sont des particules électriquement chargées sensibles à l’influence des bornes positive et négative du générateur
- Les anions sont négatifs et se déplacent en direction de la borne positive.
- Les cations sont positifs et se déplacent en direction de la
borne négative.
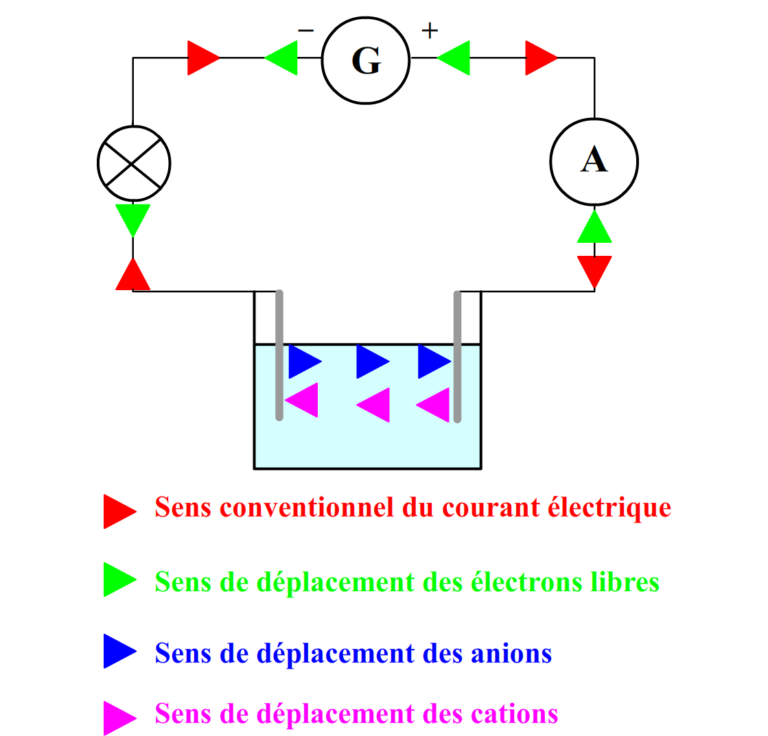
Principe général de la corrosion du fer et des aciers ou fontes
Anode :
- Oxydation / Corrosion
- Consommation des HO— = Le pH ↓= plus acide
- Perte de matière
- Différence de Potentiel Fer/électrolyte devient plus positive
Cathode :
- Réduction / Polarisation
- Concentration des HO— = le pH ↑ = plus basique
- Dégazement des H2
- Différence de Potentiel Fer/électrolyte devient plus négative
Notions du « Potentiel »
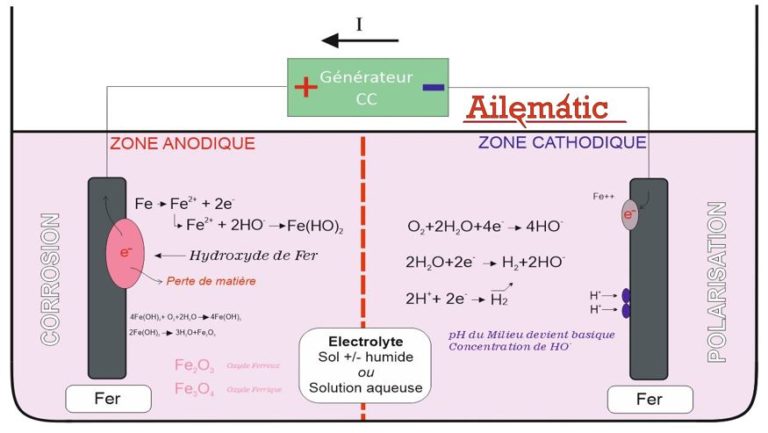
La mesure d’un potentiel (ou différence de potentiel) se réalise en relevant la tension entre l’objet métallique et une électrode de référence.
Les potentiels standards d’oxydo-réduction sont référencés suivant l’électrode ESH (Électrode Standard à l’Hydrogène), c’est une électrode de laboratoire. Les électrodes de terrain du type Cu/CuSO4 – Ag/AgCl/Eau de mer – Ag/AgCl/KCI 0,1N – Électrode au Calomel saturé, sont étalonnées en fonction de l’ESH.
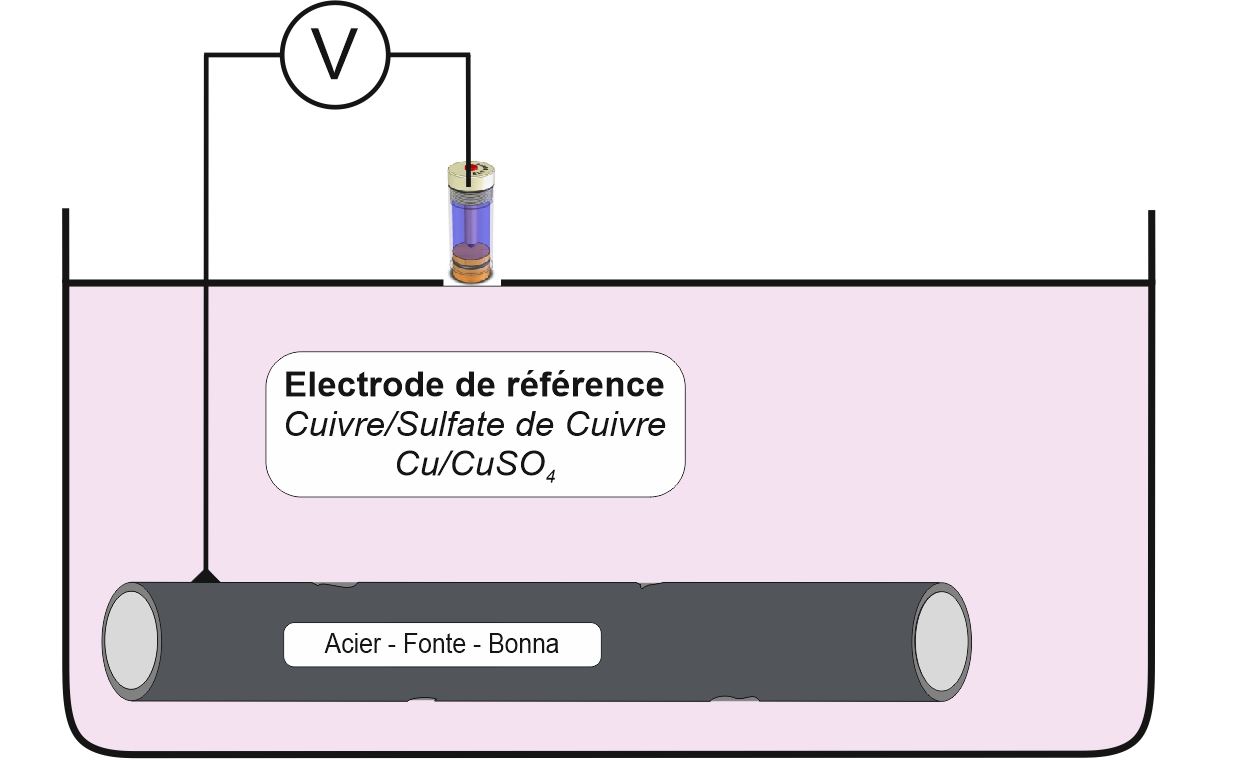
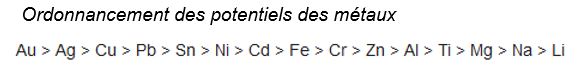
Potentiels que prennent certains métaux dans un sol type par rapport à l’électrode Cuivre / Sulfate de cuivre :
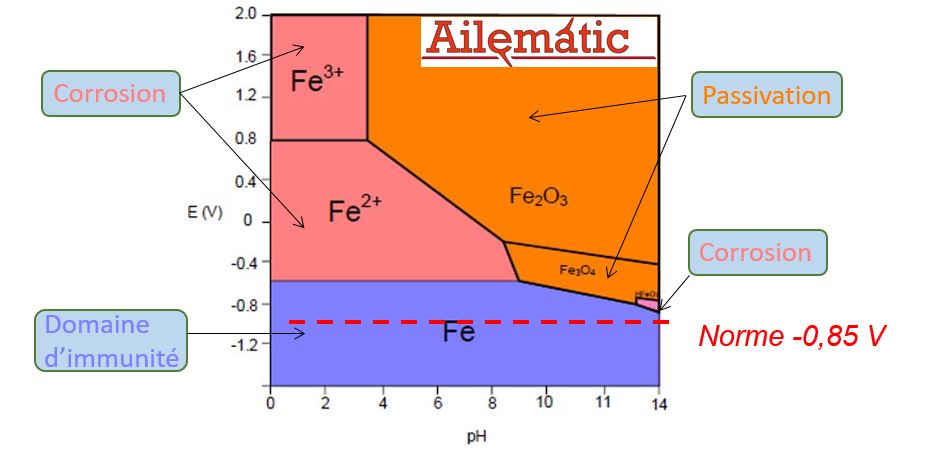
Diagramme de Pourbaix
Le diagramme de Pourbaix ci-après concerne le Fer; il existe différents diagrammes de Pourbaix suivant le métal étudié…
Le diagramme de Pourbaix nous permet d’évaluer les domaines :
- de corrosion
- de passivation
- d’immunité
des différents matériaux en fonction du pH du milieu (électrolyte) et suivant le potentiel mesuré par rapport à l’électrode Cu/CuSO4
Nos solutions
Protection Cathodique par anode sacrificielle galvanique
- Implantation d’anode galvanique magnésium
- Implantation d’anode galvanique zinc
- Implantation d’anode Aluminium
Diagnostique et contrôle de la protection cathodique par Ailematic
- Dimensionnement des protections par anode galvanique
- Dimensionnement des protections cathodique par courant imposé (Ailematic)
- Contrôle et maintenance des systèmes de protection cathodique par le technicien certifié Ailematic
Protection Contre la Corrosion Active
- Fourniture de poste de soutirage Ailematic (redresseur connecté)
- Implantation de systèmes de protection par courant imposé et fourniture anodes Ferro-siliciums ou autres
- Implantation de prise de potentiel et soudure alumino-thermique, thermoweld.
- Implantation de systèmes de protection par courant imposé et anodes Titane MMO
- Montage et raccordement des postes de soutirage (redresseur) et paramétrage des débits du courant de protection cathodique
- Protection cathodique AILEMATIC de pipelines / cuves / station d’épuration / conduites forcées / puits d’exhaures…
- Montage et raccordement de systèmes de drainage de courant vagabond.